這篇文章我要做一件瘋狂的事情,把這個整整一小時行雲流水的化學展示中的每一個實驗列出來。
我注意皇家研究院的 YouTube 頻道已經很久←說這話的語氣很重要,不小心就會很母湯「嘿嘿嘿嘿~~我注意你很久惹~~」
皇家研究院頻道的超多免費演講中,有兩位講者的化學公眾展示/演講,我個人最喜歡,籌備得很強很有梗,適合闔家觀賞。即使孩童也會被驚奇娛樂到,而即使具備基本知識了也有新啟示(實驗很有主題性)。我喜愛的兩個講者是 Peter Wothers 教授,和本文這影片中的 Chris Bishop 教授。呃,另外有位白髮的 Andrew Szydlo 教授 他喜歡扯嗓子,就比較不喜歡。
難能可貴的是,其實 Bishop 教授本人根本不是化學家。他卻顯然是擅長公開演講的人,迷人的口音有加分,輔以高超的控場力,最重要的他對於化學反應有哲學性的掌握。加以精良籌備的完整程度......種種種種,使這場演講「此曲只應天上有,人間哪得幾回聞」。
演講的主題,雖讀起來有點空泛「化學奇觀:驚奇科學與戲劇性的演示」(Chemical Curiosities: Surprising Science and Dramatic Demonstrations)......有些芭樂。
但他的真正主題很深,藉由展示「每一類林林總總的化學反應」,最後鋪陳出「化學反應 到底是怎麼回事?為何會發生?」
但他的真正主題很深,藉由展示「每一類林林總總的化學反應」,最後鋪陳出「化學反應 到底是怎麼回事?為何會發生?」
Chris Bishop 教授是誰?他本人是英國微軟公司研發總部的主任,所學本科是物理,從物理跨界到人工智能。著作《模式識別與機器學習》 (Pattern Recognition and Machine Learning) 被學術引用超過四萬次。高人!←而且這本書現在他開放所有人免費下載 pdf 電子書惹,真香。
總之,開始條列吧 *科宅必勝*(綁頭巾)以下附上時間碼:
▆ 0:01:20 無色液體倒入無色液體中,一開始出現淡紫色,但整杯倒完居然又變成無色。緊接上述實驗,拋出其實是整場演講的文眼與懸念:【什麼是化學反應?化學反應可以逆轉嗎?】
無色變紫又變無色的秘密是另一種鹼性指示劑百里酚酞(Thymolphthalein),Thyme 就是 Parsley, sage, rosemary, and thyme (歐芹,鼠尾草,迷迭香和百里香)裡的百里香。在酸性呈無色,鹼性呈紫色。左側杯子含有酸性溶液中加入百里酚酞,右側杯子含有鹼。一開始倒的時候,鹼比酸的當量多,百里酚酞呈紫色,但越來越多酸性倒進右杯,鹼性完全被中和,就又恢復無色。
【酸 + 鹼 → 水 + 鹽】,但似乎沒有聽過能把水和鹽分解為酸與鹼的反應?(其實有,但那是需要插電的電解反應)所以化學反應能倒退嗎?
▆ 0:03:55 彩色水化學魔術(酸鹼),一大筒預先用氫氧化鈉鹼化的廣用試劑溶液,表演時在底部加入乾冰。
乾冰是固態二氧化碳,在 -78.5°C 昇華為氣體,在一般大氣壓力之下會跳過液體,之所以叫乾。同時二氧化碳也是酸性的,且易溶於水(形成碳酸)。當乾冰入水,從水吸熱而快速昇華,冒出二氧化碳氣泡,許多立即溶解在水中,使鹼性液體逐漸母湯(x) 酸化(o),廣用試劑便逐漸變色。
二氧化碳是酸的,這實驗同時彰顯了「全球暖化」必定伴隨著海洋酸化問題的原因。
乾冰是固態二氧化碳,在 -78.5°C 昇華為氣體,在一般大氣壓力之下會跳過液體,之所以叫乾。同時二氧化碳也是酸性的,且易溶於水(形成碳酸)。當乾冰入水,從水吸熱而快速昇華,冒出二氧化碳氣泡,許多立即溶解在水中,使鹼性液體逐漸母湯(x) 酸化(o),廣用試劑便逐漸變色。
二氧化碳是酸的,這實驗同時彰顯了「全球暖化」必定伴隨著海洋酸化問題的原因。
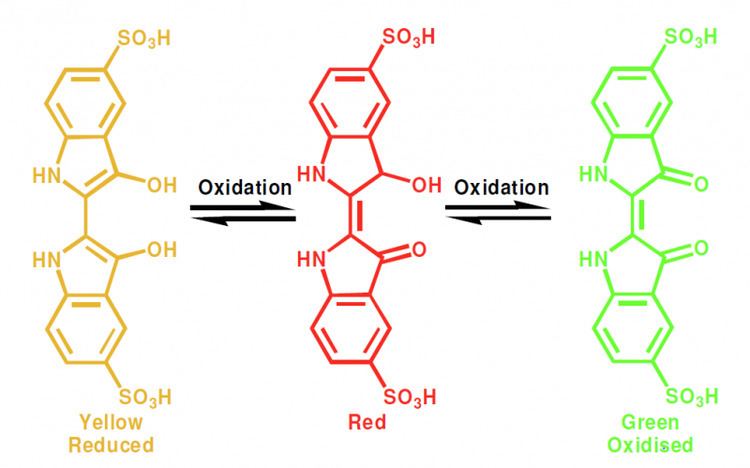
▆ 0:05:16 化學魔術,氧化還原之【裁判!顏色可以這樣變了又變的嗎?】
首先在球形燒瓶中無色的溶液,只要用力搖晃就會變成藍色。另一瓶中的黃色液體,輕輕搖晃變紅,更用力搖會變黃、再變綠。
最神奇的,搖晃後靜置幾分鐘,剛才的變色逆轉,綠色變回紅→黃色。藍色則褪成無色。這個擺盪不定的過程可以一直玩,一直玩好幾次。
首先在球形燒瓶中無色的溶液,只要用力搖晃就會變成藍色。另一瓶中的黃色液體,輕輕搖晃變紅,更用力搖會變黃、再變綠。
最神奇的,搖晃後靜置幾分鐘,剛才的變色逆轉,綠色變回紅→黃色。藍色則褪成無色。這個擺盪不定的過程可以一直玩,一直玩好幾次。
秘密是空氣。有機商人喜歡說他們的農產品不含化學物,但空氣本身就是化學物,還蠻複雜的,除了主要的氮與氧還有氬、氪、二氧化碳與水氣等。在這個實驗中起作用的是占 21% 的氧氣。
這次燒瓶中加的指示劑不是酸鹼指示劑了,而是【氧化還原指示劑】。變藍的瓶子中含有甲基藍(methylene blue)染料,混合了葡萄糖。當用力搖晃時,空氣中的氧氣把甲基藍氧化,讓它的分子結構改變成另一種形狀,顯現為藍色。溶液中的葡萄糖在此兼任還原劑,過一會兒就把氧化的甲基藍「還原」,變回無色的分子。
遭到氧化會從黃變紅變綠的染料則是「靛藍胭脂紅」(Indigo carmine)這種名字充滿矛盾的染料,一樣是由葡萄糖這種「還原糖(醛糖)」負責逆轉氧化狀態。
遭到氧化會從黃變紅變綠的染料則是「靛藍胭脂紅」(Indigo carmine)這種名字充滿矛盾的染料,一樣是由葡萄糖這種「還原糖(醛糖)」負責逆轉氧化狀態。
 |
| 靛藍胭脂紅染料/指示劑:出處與更多說明見此 |
這是【碘鐘(Iodine clock)反應】,準備簡單,效果驚人。一開始劇烈攪拌的溶液含有碘化鉀、澱粉和硫代硫酸鈉。加入的是酸性的過氧化氫溶液。過氧化氫是氧化劑,硫代硫酸鈉是強還原劑。兩者開始一場爭奪碘離子身上的電子的遊戲:碘離子帶有一個多的電子,氧化劑喜歡把它搶走,還原劑喜歡把自己的電子送人。
於是過氧化氫開始氧化碘離子,生成分子碘(I₂)繼而生成三碘離子(I⁻+I₂→I₃⁻)。三碘離子和澱粉會形成深藍黑色的複合物,是長鏈狀的澱粉綑綁著三碘離子的特殊結構。
戲劇性的瞬間變色效果的成因是,過氧化氫氧化碘離子的速度慢,但硫代硫酸根的將碘還原速度超快,於是,碘一直是剛被搶走電子就又被塞一顆這樣無奈的狀態......直到硫代硫酸根用盡(快樂王子般的角色:一味貢獻電子給別人QQ),就沒人阻撓過量的過氧化氫了,深藍色的「澱粉三碘離子複合體」的深藍黑色終於跑出來。
於是過氧化氫開始氧化碘離子,生成分子碘(I₂)繼而生成三碘離子(I⁻+I₂→I₃⁻)。三碘離子和澱粉會形成深藍黑色的複合物,是長鏈狀的澱粉綑綁著三碘離子的特殊結構。
 |
| 螺旋型的 amylose-triiodine complex [source] |
大學化學用這個實驗來寫報告(x) 探討化學反應機構、濃度與溫度對反應速率的影響,以及 log-log 圖的妙用等等。按下不表。
▆ 0:09:40 三杯碘鐘 ←決不是叫這個名字XD 這次有三杯無色液體混合。混合完成後立刻變成一種曖昧的橘色,接著再迅速變黑。
碘鐘有各種變體,總而言之就是利用各種中間反應阻撓三碘與澱粉變黑的命運。因為這實驗教授他完全沒說明,害我大囧。但讚嘆 YouTube 神通廣大,我找到了一個影片說明這個變體:【萬聖節碘鐘(Halloween iodine clock)】以及它的維基百科。既然原演講中沒有講解,我也就不多嘴惹。
簡單來講.....咦還是多嘴了XD 萬聖節變種是基於碘酸鹽+亞硫酸還原的碘鐘。但作為中途的阻撓,加入了不太妙的二價汞鹽。碘化汞(II) 是一種可疑的橘紅色固體。如果各位家裡有古董版急救包,裡面含汞的紅藥水和碘酒互相混合就會產生這種顏色。
汞離子和碘離子的溶度積超小,白話文是超級難溶解、會迅速沉澱,在汞耗盡之前基本上溶液裡不會有碘離子。當汞耗盡,碘離子 + 碘酸鹽 → 三碘離子 黑化的宿命才終於完成。
▆ 0:10:12 進入新的章節,展示「會使物質的狀態改變」(相變)的化學反應。首先是兩杯液體小心的倒在一杯,但上下分層,在兩頁體交界處開始持續形成固體。這個反應的產物是【尼龍纖維】,兩杯分別是己二酸和己二胺,會以醯胺鍵/肽鍵(amide / peptide bond)串在一起,是種高分子聚合反應,白話文是分子手牽手串成長鏈子。
▆ 0:12:24 出現了可愛的正太,以及非常經典的【銀鏡反應】。用過量氨水溶解硝酸銀,得到無色的二氨銀溶液(多侖試劑),化學上可以用來測試有機物是否含有可以被氧化的「官能基」,白話文是分子配件。但更常是被拿來製造鍍銀的玻璃鏡面→所以才叫銀鏡反應囉。
這裡再次請出還原糖葡萄糖,遇到二氨銀,葡萄糖(醛)被氧化成葡萄糖酸,銀離子則被還原成金屬銀,黏在玻璃表面。
▆ 0:16:25 【熱冰實驗】過飽和醋酸鈉,在有「晶種」的催化之下可以迅速的結晶。
▆ 0:17:27 延伸說明,「熱冰」形成的過程會放熱,可以用來做可重複使用的暖暖包。
在於,加熱可以大大提升醋酸鈉在水中的溶解度,加熱後再冷卻可使暖暖包處在一個「亞穩定」(metastable)的狀態,也就是過飽和。這時反覆彎曲包裝內的金屬片,產生裂紋或微小斷片的金屬作為晶種,讓醋酸鈉快速結晶,並放出一些熱量暖手。
▆ 0:18:40 【碳蛇】之術(x) 反應(o) 。
在固體「對硝基苯胺」(p-nitroaniline)結晶中加入幾滴濃硫酸,加熱到晶體熔化,並開始沸騰的程度,混合物會迅速變黑並開始沸騰冒煙,燒杯中一瞬間沖出一條漆黑的猥褻物。本反應中,硫酸的強脫水性,強制讓對硝基苯胺分子之間兩兩脫水,接在一起。產物是串在一起的碳碳碳...碳碳碳(無定型固態碳)。
對硝基苯胺這招,與「法老之蛇」實驗和「小蘇打糖蛇炮」相似之處在於產物都是固體的無定型碳黑。但是,對硝基苯胺這招是會在一瞬間噴發(水蒸汽與氮氣)帶起一根矗立的旋風阿姆斯特朗之黑蛇,戲劇效果十足。
做完這招稍做休息,Bishop教授繼續在與觀眾灌輸懸念:
【除了剛才看到的變色和改變狀態,化學反應還可以有哪些效果?
化學反應可以逆轉嗎? 化學反應一開始究竟為什麼會發生?】
▆ 0:20:33 整場最簡單的實驗。氫氣球在空氣中點火燃燒。
▆ 0:21:08 在振奮觀眾全心全意的許願之下,助手先生持承載大眾歡笑的巨大紅色氫氣球進場float with me,點火、華麗地爆開成一球紅色的火焰。
教授解說,燃燒釋放熱量+發光+聲波(砰)等不同形式的能量,現場大家都有感受到。這反應的發生可以想成,氣球中的純氫氣與空氣中 21% 的氧氣,原本總體承載著稍微高的能量,燃燒發生時,氫與氧原子重排成水蒸氣,整體含有較少的能量,但世界上的能量總額守恆,於是從高到低的能量差額,就以聲、光與熱放出。
如果所有的化學反應都像這樣,如同球從山上滾到山下,那麼似乎就沒有可能使相反的反應(自動)發生了?抱持這個懸念,繼續示範。
*這裡我要自作主張補充兩件事,一個是安全須知,一個是迷思驅除:
1. 「引爆(detonation)與爆燃(deflagration)」的不同
影片中的氣球雖然有爆破聲也有火焰,但其實並不是爆炸,而只是氫氣的擴散燃燒(砰一聲幾乎肯定來自氣球的壓力)。這要從反應速度看,燃燒學中,引爆(detonation) 的定義很嚴格,是化學反應速度超過材料中的音速,音速是爆破的機械能量傳遞的最快速度,因此超過音速的引爆會使得化學物的能量不及分散,全部集中於一個時間點釋放出來,和主角的捨身大絕招一樣,最為危險也具有破壞力。
這個區別在 Chris Bishop 教授後來另一場有趣/危險得多的演講:《火箭與爆破的科學》(2014) 有提到,但在這場不是重點就略過了。
炸藥王諾貝爾就發現了這個區別:化學反應的速度正比於溫度,而釋放出的能量在炸藥中的傳遞速度取決於溫度與壓力,所以讓炸藥的能量能一次引爆,破壞力暴增的關鍵就是把炸藥裝在堅固的密閉小空間裡。當反應開始,高溫高壓被拘束住,導致反應加速,加速釋放更多能量,能量又加速反應......形成正回饋,反應速度指數飆升,便能達到「集中所有能量於一點」的效果。
爆燃(deflagration)常發生在沒被拘束的化學反應——不是鞭炮而是仙女棒,放出的能量雖然肉眼來看也挺快的,但始終並不超過音速。如同一開始氣球破掉後,開始與空氣混合並快速燃燒的氫氣。
這個實驗中兩個氣球裡裝的都是純氫氣,需要一小段時間與空氣混合才能完全反應,比較安全。另一種則超危險,不可能在滿是人的演講廳中示範的爆炸,只要把這裡的純氫氣換成 氫氧 2:1 體積混合氣,氫氧混合氣的點燃會是超音速的引爆。[這兒有 一個優異的高速攝影比較影片,可以注意到,氫氧氣球引爆時,在氣體的範圍幾乎沒擴散開時火焰就吞噬了整個球型體積,因為氣體擴散的速度約等於音速]
2. 「氫氣的火焰是無色的」迷思
在 Periodic Video 系列中有一個有趣的橋段是 Poliakoff 教授看到氫氣球爆開後,立刻產生了一個疑惑:「我們用的氫氣是不是被汙染了,不純?不然那個火怎麼會是紅色的?」
我看到的第一個疑惑也一樣,有點感到榮幸嘿。因為「氫氣的火焰發光中,光波分別是強烈的紫外線和紅外線,沒有多少可見光,所以眼睛幾乎看不到」幾乎成了一種化學野史、專家與非專家的共識。例如用本生燈燃燒氫氣,只有淡淡的、幾乎透明的藍色火焰。近代環保氫能崛起,更產生了「必須設法預防滲漏的氫氣起火,但高溫的氫氧火焰卻肉眼不可見所造成的危險」的研究。
但氫氣火焰真的是完全不可見嗎?錯惹。真的這是迷思。氫火焰會發出強紫外線的理由是燃燒「中間步驟」的化學發光(chemiluminescence),中間步驟是指一些不穩定的自由基重新組合的過程,會發出紫外線的是氣態氫氧自由基(‧OH)。
但是我們不是看過很多次 NASA 火箭發射,其中阿波羅任務用的發射系統農神五號火箭,和後來發射太空梭用的 SLS 系統用的都是液氫+液氧推動的——那個火焰明顯不是透明的,而是有紅有藍。這些總不會都是污染?
當然不是XD 原來,紅色的光譜來自於燃燒的最終產物水,水分子的震盪與旋轉產生的光譜(類似拉曼光譜)貢獻了氫氧火焰的紅色可見光部分。而藍色的部分......我剛確認了,到目前 (2019) 都還是一個 科學未解之謎。關於這段 blue continuum 兩個主要理論是 ‧OH + ‧OH → H₂O₂ 相關的發光,或者 ‧OH+ H → H₂O 的發光。
▆ 0:24:51 把 -196°C 的液態氮倒進一盆溫水裡。溫水的熱量使液態氦沸騰,膨脹,過程中挾帶很多水的微小液滴,形成不透明的白霧。教授:「這實驗完全沒重點,只是好玩。」(眾笑)
汞離子和碘離子的溶度積超小,白話文是超級難溶解、會迅速沉澱,在汞耗盡之前基本上溶液裡不會有碘離子。當汞耗盡,碘離子 + 碘酸鹽 → 三碘離子 黑化的宿命才終於完成。
▆ 0:10:12 進入新的章節,展示「會使物質的狀態改變」(相變)的化學反應。首先是兩杯液體小心的倒在一杯,但上下分層,在兩頁體交界處開始持續形成固體。這個反應的產物是【尼龍纖維】,兩杯分別是己二酸和己二胺,會以醯胺鍵/肽鍵(amide / peptide bond)串在一起,是種高分子聚合反應,白話文是分子手牽手串成長鏈子。
▆ 0:12:24 出現了可愛的正太,以及非常經典的【銀鏡反應】。用過量氨水溶解硝酸銀,得到無色的二氨銀溶液(多侖試劑),化學上可以用來測試有機物是否含有可以被氧化的「官能基」,白話文是分子配件。但更常是被拿來製造鍍銀的玻璃鏡面→所以才叫銀鏡反應囉。
這裡再次請出還原糖葡萄糖,遇到二氨銀,葡萄糖(醛)被氧化成葡萄糖酸,銀離子則被還原成金屬銀,黏在玻璃表面。
▆ 0:16:25 【熱冰實驗】過飽和醋酸鈉,在有「晶種」的催化之下可以迅速的結晶。
▆ 0:17:27 延伸說明,「熱冰」形成的過程會放熱,可以用來做可重複使用的暖暖包。
在於,加熱可以大大提升醋酸鈉在水中的溶解度,加熱後再冷卻可使暖暖包處在一個「亞穩定」(metastable)的狀態,也就是過飽和。這時反覆彎曲包裝內的金屬片,產生裂紋或微小斷片的金屬作為晶種,讓醋酸鈉快速結晶,並放出一些熱量暖手。
▆ 0:18:40 【碳蛇】之術(x) 反應(o) 。
在固體「對硝基苯胺」(p-nitroaniline)結晶中加入幾滴濃硫酸,加熱到晶體熔化,並開始沸騰的程度,混合物會迅速變黑並開始沸騰冒煙,燒杯中一瞬間沖出一條漆黑的猥褻物。本反應中,硫酸的強脫水性,強制讓對硝基苯胺分子之間兩兩脫水,接在一起。產物是串在一起的碳碳碳...碳碳碳(無定型固態碳)。
對硝基苯胺這招,與「法老之蛇」實驗和「小蘇打糖蛇炮」相似之處在於產物都是固體的無定型碳黑。但是,對硝基苯胺這招是會在一瞬間噴發(水蒸汽與氮氣)帶起一根矗立的旋風阿姆斯特朗之黑蛇,戲劇效果十足。
做完這招稍做休息,Bishop教授繼續在與觀眾灌輸懸念:
【除了剛才看到的變色和改變狀態,化學反應還可以有哪些效果?
化學反應可以逆轉嗎? 化學反應一開始究竟為什麼會發生?】
▆ 0:20:33 整場最簡單的實驗。氫氣球在空氣中點火燃燒。
▆ 0:21:08 在振奮觀眾全心全意的許願之下,助手先生持承載大眾歡笑的巨大紅色氫氣球進場
教授解說,燃燒釋放熱量+發光+聲波(砰)等不同形式的能量,現場大家都有感受到。這反應的發生可以想成,氣球中的純氫氣與空氣中 21% 的氧氣,原本總體承載著稍微高的能量,燃燒發生時,氫與氧原子重排成水蒸氣,整體含有較少的能量,但世界上的能量總額守恆,於是從高到低的能量差額,就以聲、光與熱放出。
如果所有的化學反應都像這樣,如同球從山上滾到山下,那麼似乎就沒有可能使相反的反應(自動)發生了?抱持這個懸念,繼續示範。
 |
| 西西弗斯的化學寓言 |
1. 「引爆(detonation)與爆燃(deflagration)」的不同
影片中的氣球雖然有爆破聲也有火焰,但其實並不是爆炸,而只是氫氣的擴散燃燒(砰一聲幾乎肯定來自氣球的壓力)。這要從反應速度看,燃燒學中,引爆(detonation) 的定義很嚴格,是化學反應速度超過材料中的音速,音速是爆破的機械能量傳遞的最快速度,因此超過音速的引爆會使得化學物的能量不及分散,全部集中於一個時間點釋放出來,和主角的捨身大絕招一樣,最為危險也具有破壞力。
這個區別在 Chris Bishop 教授後來另一場有趣/危險得多的演講:《火箭與爆破的科學》(2014) 有提到,但在這場不是重點就略過了。
炸藥王諾貝爾就發現了這個區別:化學反應的速度正比於溫度,而釋放出的能量在炸藥中的傳遞速度取決於溫度與壓力,所以讓炸藥的能量能一次引爆,破壞力暴增的關鍵就是把炸藥裝在堅固的密閉小空間裡。當反應開始,高溫高壓被拘束住,導致反應加速,加速釋放更多能量,能量又加速反應......形成正回饋,反應速度指數飆升,便能達到「集中所有能量於一點」的效果。
爆燃(deflagration)常發生在沒被拘束的化學反應——不是鞭炮而是仙女棒,放出的能量雖然肉眼來看也挺快的,但始終並不超過音速。如同一開始氣球破掉後,開始與空氣混合並快速燃燒的氫氣。
這個實驗中兩個氣球裡裝的都是純氫氣,需要一小段時間與空氣混合才能完全反應,比較安全。另一種則超危險,不可能在滿是人的演講廳中示範的爆炸,只要把這裡的純氫氣換成 氫氧 2:1 體積混合氣,氫氧混合氣的點燃會是超音速的引爆。[這兒有 一個優異的高速攝影比較影片,可以注意到,氫氧氣球引爆時,在氣體的範圍幾乎沒擴散開時火焰就吞噬了整個球型體積,因為氣體擴散的速度約等於音速]
2. 「氫氣的火焰是無色的」迷思
在 Periodic Video 系列中有一個有趣的橋段是 Poliakoff 教授看到氫氣球爆開後,立刻產生了一個疑惑:「我們用的氫氣是不是被汙染了,不純?不然那個火怎麼會是紅色的?」
我看到的第一個疑惑也一樣,有點感到榮幸嘿。因為「氫氣的火焰發光中,光波分別是強烈的紫外線和紅外線,沒有多少可見光,所以眼睛幾乎看不到」幾乎成了一種化學野史、專家與非專家的共識。例如用本生燈燃燒氫氣,只有淡淡的、幾乎透明的藍色火焰。近代環保氫能崛起,更產生了「必須設法預防滲漏的氫氣起火,但高溫的氫氧火焰卻肉眼不可見所造成的危險」的研究。
但氫氣火焰真的是完全不可見嗎?錯惹。真的這是迷思。氫火焰會發出強紫外線的理由是燃燒「中間步驟」的化學發光(chemiluminescence),中間步驟是指一些不穩定的自由基重新組合的過程,會發出紫外線的是氣態氫氧自由基(‧OH)。
 |
| 氫火焰是無色的才怪 ;p |
當然不是XD 原來,紅色的光譜來自於燃燒的最終產物水,水分子的震盪與旋轉產生的光譜(類似拉曼光譜)貢獻了氫氧火焰的紅色可見光部分。而藍色的部分......我剛確認了,到目前 (2019) 都還是一個 科學未解之謎。關於這段 blue continuum 兩個主要理論是 ‧OH + ‧OH → H₂O₂ 相關的發光,或者 ‧OH+ H → H₂O 的發光。
 |
| Schefer, Robert W., et al. "Visible emission of hydrogen flames." Combustion and flame 156.6 (2009): 1234-1241. [ DOI: 10.1016/j.combustflame.2009.01.011 ] |
▆ 0:25:37 將氧氣鋼瓶通過浸泡在液態氮的低溫銅管,製造液態氧。液態氧是淡藍色的。將液態氧倒進球形大玻璃罐,用力搖晃,液氧沸騰轉為氧氣,填充整個罐子。(教授:其實我們可以不用這麼麻煩,可以用鋼瓶直接充,但這樣比較好玩 [眾笑])。
▆ 0:27:22 【白磷太陽實驗】(phosphorus sun)
教授從小瓶中拿出一塊白磷。白磷是元素磷的兩種主要同素異形體(allotrope)之一,可以想像成原子結晶成分子的方式不同,猶如石墨和鑽石的例子般產生的不同——另外一種同素異形體是紅磷。
白磷非常活躍,會在空氣中自燃,因此需要保管在水中。用彎成L形的金屬勺子承載白磷,放在剛剛已做成純氧的玻璃瓶中,這過程中白磷已經在微微冒煙,隨時都會燒起來。為了效果,用燒紅的玻璃棒接觸瓶中的白磷點燃。冒出燦爛的白光。磷元素(phosphor)的名字是 「光的攜帶者」的意思。
玻璃罐旁邊由管子通到一盆水中,看似產生很多氣體從管子衝出來,但其實白磷燃燒應該只產生固體的十氧化四磷(P₄O₁₀),反倒應該消耗氧氣,把水倒吸回瓶子裡才對!這其實是因為燃燒放出能量,加熱瓶中的氧氣,密閉瓶中氣體膨脹才被擠出。通過水的用意是讓十氧化四磷(=磷酸酐=脫水的磷酸)和水反應生成磷酸。不然這玩意被觀眾呼吸進去,就會在肺裡面形成磷酸,就慘了。
順帶一提,白磷超級毒,比柯南的最愛氰化鉀更毒,實驗室的管控得非常嚴格才行。
▆ 0:29:19 【看試管學狗叫】一起汪汪汪汪汪(barking dog)實驗
長試管中預先充滿無色的一氧化氮氣體,實驗者滴進一些澄清的二硫化碳液體,讓液體在試管兩端轉一轉,二硫化碳逐漸揮發,與一氧化氮混合。
然後點火,一瞬間青藍色火焰猛烈的從管口向下衝,發出由尖到低沉的呼嘯聲。這實驗被發明至少一百六十幾年了,持續地受觀眾歡迎。
▆ 0:30:40 魔術化學【著火卻不燃的紙鈔】
將 50 英磅大鈔浸泡到透明液體中,點火,著火,火熄了紙鈔毫髮無傷。那個神祕液體是 50 度的酒,酒精與水 1:1 混合。酒精著火的同時,水吸收大量的熱能,並將溫度控制在紙鈔的燃點之下。
▆ 0:31:50 滅火器有三類,適用於不同火源的火災。有時候用錯種類反而會讓火勢更糟糕。英國有種灌了加壓空氣的清水滅火器,在台灣就很不常見。有沒有哪種火災絕對不能用水灑呢?
▆ 0:33:45 出現了小蘿莉。她用殺手般的精確度將水槍射中了裝有奇怪粉末的金屬盤,引發一陣白色亮光。
原來盤中的粉末是鎂粉和硝酸銀,本來是固體的兩者共處也不起反應,但一點點水溶解硝酸銀,使一價銀離子能自由地去「襲擊」鎂金屬,搶走一顆電子,變回金屬銀(銀非常想要做自己),這「氧化還原反應」產生的熱隨即引燃了整盤鎂粉,在空氣中燃燒並產生白光。
▆ 0:34:24 二氧化碳滅火器。在鋼瓶中的高壓(約100大氣壓)會使二氧化碳保持在液態。因此拉拉壓,拉插銷、拉噴嘴、壓下把手就會釋放出高壓的氣態二氧化碳。
其中變冷、水霧凝結是副作用,而傳統綜藝節目都會說這叫「噴乾冰」,現在我們知道這不貼切,因為在瓶中的確實是「濕」的二氧化碳。如果用二氧化碳滅火器對著布袋噴,液態二氧化碳將會降壓,才會形成固態的乾冰。
另外如果把鋼瓶加熱到 31.04 °C 以上,二氧化碳會從液態轉為「超臨界態」。超臨界態二氧化碳有很多工業用途,兼具氣體和液體的一些性質,是個好物。二氧化碳的三相變化和水很不一樣。
另外如果把鋼瓶加熱到 31.04 °C 以上,二氧化碳會從液態轉為「超臨界態」。超臨界態二氧化碳有很多工業用途,兼具氣體和液體的一些性質,是個好物。二氧化碳的三相變化和水很不一樣。
二氧化碳之所以能滅火,可以想成它是所有含碳物在氧氣中燒到不能再燒的最終產物,所以,當空氣中助燃的氧氣被毫無作用、只是個渣的二氧化碳排開的時候火就熄了。
▆ 0:35:45 但是,在兩塊乾冰中間夾顆粒狀的金屬鎂,並點火。火不只沒被遇熱氣化的二氧化碳撲滅,完全無視二氧化碳,繼續燃燒。
燃燒產生白煙,那是微小的固態氧化鎂顆粒飛散在空氣中,強鹼性,千萬不要吸進鼻子。雖然氧化鎂 MgO 是胃酸制酸錠的常見原料,並不太危險。
火能繼續燒是因為鎂金屬足夠活潑,能硬生生從二氧化碳分子身上把氧剝下來給自己用,過程中留碳孤伶伶的自己單身在那邊黑。NTR 簡直不道德啊。 2Mg+CO₂ → 2MgO + C。
火能繼續燒是因為鎂金屬足夠活潑,能硬生生從二氧化碳分子身上把氧剝下來給自己用,過程中留碳孤伶伶的自己單身在那邊黑。NTR 簡直不道德啊。 2Mg+CO₂ → 2MgO + C。
▆ 0:37:15 乾粉滅火器,傳統的乾粉滅火器是小蘇打(碳酸氫鈉),滅火原理是被噴到火堆中的碳酸氫鈉分解為碳酸鈉,水和二氧化碳。由後者奪取火源的熱量(水吸熱)與氧氣(二氧化碳體積排擠氧氣)。
那麼,有乾粉也無法撲滅的火嗎?
▆ 0:38:00 宋代中國之光:黑火藥。由黑炭粉、硫磺、硝石(硝酸鉀)三種固體粉末混合。硝酸鉀受熱放出氧氣,是一種強氧化劑。炭粉是燃料。硫磺的存在是為了催化。因為黑火藥的原料都是固體,化學反應起來不相接觸,效果會很差。硫磺一受熱就變成液體,讓燃料和氧化劑更好的交融在一起,起到加速的效果。
順帶離題,硝石的英文是 saltpeter,這個 peter 彼得是在紀念誰呀?其實這是誤會,是崩壞的古文字,原本是希臘文 petra 石頭之意,因此不是「鹽彼得」,而是「石頭中的鹽」。
▆ 0:39:18 如果用和滅火器乾粉類似的碳酸鉀(KNO₃)代替黑火藥中的碳粉,想一下,這可是用可以滅火的東西代替了燃料喔。所得到的混合物被人稱為「煙火黃粉」(pyrotechnic yellow powder)。將黑火藥和黃粉分別在兩個酒精燈上加熱,熱度將會熔化黃粉、點燃黑火藥......
▆ 0:40:20 黃粉砰一聲爆炸,接著 0:40:25 黑火藥快速燃燒。這裡只有加了碳酸鉀的黃粉產生的是引爆,黑火藥只是爆燃(還記得兩者差別在反應速度齁。黑火藥沒有被拘束在小容器,故比較遜)。
對於到底為啥黃粉會爆炸,目前還沒有人知道 ← 真的,和剛剛說的氫火焰是藍色的原因一樣,還沒有人確切地知道。進擊吧!科學家。
▆ 0:40:55 來了來了,重頭戲終於來了。化學振盪反應(oscillating reactions)。
當 Bishop 教授反覆的問「化學反應能不能回頭?」的時候,身為一個科宅就當然會想到異常複雜、異常酷炫,並很有啟發意義的一個歷史性實驗:Belousov-Zhabotinsky 別洛索夫-扎鮑廷斯基反應。
因為沒有人記得住這兩位俄國人的名字,史簡稱 B-Z 反應。我不膽敢解釋這種 Boss 級的、至今也沒人敢說完全懂了(但已有很好的模型)的複雜反應,因此請參考維基百科、和國內外無數科展的成果報告。
B-Z反應最炫的除了會振盪之外,當不主動施與攪拌時,化學反應物只能透過分子的擴散(由熱運動與濃度差異驅動)彼此相遇,會形成行進波反應(chemical traveling waves)。白話文是和活著的東西異常相似。
想到當初別洛索夫先生正是想研究生物體內的化學反應:檸檬酸循環。才開啟了振盪反應之門。這樣的巧合實在很合適。
B-Z反應和碘鐘反應類似是有很多版本的配方,這場演講中用的配方應該是與這個影片相同。有放丙二酸、溴化鉀、溴酸鉀、三/四價鈰離子、試亞鐵靈(ferroin, 一種氧化還原指示劑)。
▆ 0:44:30 另一種振盪反應,特別的是這個稱為 Briggs-Rauscher 布里格-勞雪反應其實是兩個高中化學老師發明的。他們在準備剛剛做過的「碘鐘反應」的課堂示範的過程中,讀到 B-Z 反應的論文,靈機一動,就把 B-Z 反應 **魔改** 成更炫炮版的振盪型碘鐘了。
其中,B-Z 的溴酸鹽換成碘酸鹽,溴離子換成碘離子,鈰離子換成錳離子,氧化還原指示劑換成澱粉。Ta-Da! 從此 B-R 反應就與 B-Z 反應相輝映。有沒有很簡單呢?
▆ 0:46:10 化學反應不一定是像石頭從山上滾到山下,也就是說也存在自發吸熱的反應,並不是所有反應都是放熱的。
用到的示範是【凍結的燒杯】實驗,將氫氧化鋇(Ba(OH)₂, 強鹼)和 氯化銨(NH₄Cl) 的固體鹽,放在燒杯中混合,燒杯底部墊一塊木塊,木塊上故意澆一點普通的水。
教授於是開始用電子溫度計的探針攪拌兩種鹽,邊攪溫度計的讀數一邊掉,原本純粹是固態鹽的杯中開始出現液體,變成一團白色的爛泥。最後溫度掉到零下,剛才澆的水結冰,燒杯就被黏在木塊上了。
這是一個著名的吸熱反應。似乎打破了「化學反應是從高能狀態變成低能狀態,放出能量的差異」的理論,看似有一顆球自己滾上山,超怪。
而且最賊的是,讓這反應之所以自發(我們無須幹嘛,只需混合使化學物接觸,它就自然會發生)的神秘關鍵,我們在影片上看不到。但如果我們到現場就會聞到!
因為氯化銨是微酸性(銨比氨多一個質子),氫氧化鋇強鹼性,所以後者會讓固體銨鹽變回臭臭的氨氣,酸鹼中和也產生了水,剩下的氯化鋇還是易溶於水中的鹽。所以呢?一開始是兩種固體合在一起,卻意外產生了氣體、液體、別忘了還有溶在水中的鹽,整體結果是,系統的「亂度」大大增加了。
可以想成有比起硬梆梆的固體,後來有更多的方式分配能量,於是原本環境中以熱(分子振動)的形式存在的能量,被氣體分子、液體和水分子、和水中自由運動的離子攜帶走了一部分,大家都變自由,於是就強烈的吸熱。
▆ 0:48:29 電腦實驗【亂度是什麼?】的類比
螢幕上有一百個圓盤原本是黃色。每一秒由電腦亂數選擇十個,若是黃色就「翻面」成紅色,若是紅色就翻回黃色。
一開始黃色迅速下降到一半左右,然後紅黃的比例就在 50:50 之間上下波動,可是瑞凡我們再也回不去 100 個都是黃色的美好狀態了。
這是因為 100 個盤子都是黃色的可能性只有 1 種,但紅色和黃色各 50 個的可能性有 C(100,50) = 10,0891,3445,4556,4193,3348,1249,7256 讀作約十萬兆兆,或十穰種,10E29 ......一個超越一般天文數字的大數。意義是,這個隨機的系統,雖然會上下波動,但處在中間值附近的可能性遠遠的大,除此之外都極微小。
更別提真實世界中的盤子:生活周遭原子與分子的數量動不動就是亞佛加厥常數 602,214,076,000,000,000,000,000 這種數字。要讓一杯咖啡牛奶自己分成半邊咖啡半邊牛奶是根本不可能的。
更別提真實世界中的盤子:生活周遭原子與分子的數量動不動就是亞佛加厥常數 602,214,076,000,000,000,000,000 這種數字。要讓一杯咖啡牛奶自己分成半邊咖啡半邊牛奶是根本不可能的。
當物理系統能量達到最均勻分配時,稱為有最大的「亂度」,因為是最可能的狀態,因此在隨機運動的宇宙中,最大亂度的狀態像是有吸引力一樣存在,像每個人的房間一樣不費力收拾就會越來越亂。
剛剛的反應中,氣態的亂度大於液態又大於固態,因此亂度法則會驅動化學反應進行,同時吸收大量熱量,稱為這個反應是亂度(熵)驅動的,而非由能量(焓)驅動的。
美國化學家吉布斯搞懂了這個關聯,寫出了一個關係式 ΔG = ΔH - T ΔS。聯繫了亂度和能量的關係,其中 G 就以他的名字稱為「吉布斯自由能」,是預測化學反應到底能不能自發性發生的最終判別。按下不表,請參見相關資料。
▆ 0:52:38 【銅與稀硝酸】的奇幻旅程
Bishop 教授提到,在英文裡 curious,也就是這場演講標題之中的一個字有兩種意思。一個是「很奇怪」,另一個是「很好奇求知」。例如《班傑明的奇幻旅程》的原書名就叫"The Curious Case of Benjamin Button"(直譯是:班傑明巴頓的奇怪案例)。
所以這裡他要用一位大前輩化學家 伊拉.倫森(Ira Remsen, 1846-1927) 的故事搭配實驗。
倫森是人工甜味劑糖精(saccharin)的發明人之一,創辦了美國約翰霍普金斯大學的化學系。小時候倫森在書上看到平淡無味的一句話「稀硝酸會和銅反應」,他搞到了一點硝酸 [好危險!],和一個銅幣,二話不說就在自己房間裡把銅幣丟到硝酸裡。
倫森是人工甜味劑糖精(saccharin)的發明人之一,創辦了美國約翰霍普金斯大學的化學系。小時候倫森在書上看到平淡無味的一句話「稀硝酸會和銅反應」,他搞到了一點硝酸 [好危險!],和一個銅幣,二話不說就在自己房間裡把銅幣丟到硝酸裡。
Bishop 教授一邊說故事一邊做相同的實驗,不同的是他懂得要在密閉的瓶中做,倫森不知道,於是下場很慘痛~~ 隨著「硝酸與銅反應」進行,冒出大量棕紅色的氣體,味道又嗆又辣的氣體——二氧化氮(NO₂)充滿了房間,幾乎要讓倫森窒息。
他只好用手把銅板從硝酸裡撈出來丟出窗外。這時他有了第二個寶貴的經驗:硝酸也會和他的手起反應——痛死了。於是他著急的用褲管想把酸液擦掉,於是獲得了第三個寶貴經驗:硝酸也會和衣物(應該是棉)起反應。
硝酸特別在於除了酸性,更是有強氧化力,其他酸溶解金屬是產生氫氣,但硝酸(~就他最特別~)則是產生氧化還原,將銅氧化、自己還原成二氧化氮。
硝酸與一氧化二氮氣體,用顯圖充當插圖兼頻道推薦
倫森從此對化學燃起極大的興趣,找尋進入專業實驗室學習的機會,最後做出了一生的諸多學術貢獻......是說倫森作為科學家實在有點落漆XD
包括他最著名的發現糖精過程也有些烏龍:他研究煤焦油(coal tar)的化學性質——煤焦油有很多含有苯結構的化合物,可以加工成染料等等有用的工業用化學物——做實驗一整天之後,終於能和太太坐下來同桌用晚餐。倫森:「老婆啊,你這小麵包味道怪怪的,有點甜,又有種苦苦的怪味」。Mrs 倫森: 「你很奇怪耶,我吃正常啊。」
真相大白,原來是他玩化學後,沒洗手就去抓麵包吃。先是非常甜然後有苦味餘韻的糖精就是這樣被發現的。倫森.....真難?
真相大白,原來是他玩化學後,沒洗手就去抓麵包吃。先是非常甜然後有苦味餘韻的糖精就是這樣被發現的。倫森.....真難?
高中化學一定會提到這章,hen重要,因為這類化學反應就是特別在於:很容易就能逆轉。例如本反應,反應式是 2 NO₂ ←→ N₂O₄ + 熱。
如果照一開始想的,認定化學反應傾向於放熱,我們可能會猜所有二氧化氮(紅棕)都會變成無色的四氧化二氮氣體。但奇特的事情是,二氧化氮還蠻穩定的,就是因為亂度法則:反應式左邊的分子數量是右邊的兩倍,兩個分開的分子更加的自由無拘束,有較高的亂度。(你,自由飛吧,你說溫室沒有燦爛的花)
因此這個例子裡,能量和亂度的效應是相反方向,結果是「二氧化氮 和 四氧化二氮 同時存在於一個系統中」勢均力敵,不停的在反應變成彼此(動態平衡)。當放進冷水中的時候,方程式右邊的熱量被拿走,就會有更多的二氧化氮轉變成四氧化二氮(後者無色,故整體顏色變淡)。當放進熱水,逆反應占優勢,更多四氧化二氮分解成二氧化氮,紅棕色變深。
* 如果壓縮容器讓壓力增加體積減少,反應向右(分子數變少)。
▆ 1:01:00 【釔鋇銅氧】高溫超導體
雖然是化學講堂,但是秀一點物理化學跨界的展示不為過ㄅ。
釔鋇銅氧(YBCO)是一種黑色的陶瓷,陶瓷的意思就是各種東西的固態氧化物,所以形成陶瓷的方式就是把各種東西拿去徹底地燒,與氧化合。
釔元素(Yttrium)一般也被列作「稀土金屬」(Rare earth elements),這是因為它的原子電荷、大小等性質都和其他稀土元素相近,在地球表面形成礦物的時候,彼此處得來(晶格相容)所以會聚集在一起。另外之所以叫稀土,是因為當初從發現者都是將礦石溶解於酸,反覆結晶純化後得到這些元素的氧化物。在西洋化學的古老傳統中,土=燒到不能再燒的東西(因此很耐火耐高溫)=陶瓷=氧化物。
釔的名字來自瑞典斯德哥爾摩市附近的一個礦坑「乙特比」(Ytterby),這裡一開始人們以為挖到黑黑的岩石是煤礦,但那礦石明顯比煤礦(碳氫的複雜混合物)來得重,應該含有某些金屬吧。後來這種礦物被叫作「加多林石」(Gadolinite),裡面至少含有八種當時十九世紀未知的元素,其中最後有四種的名字非常飲水思源的用了乙特比來命名:釔(Yttrium, Y)、鐿(Ytterbium, Yb)、鋱(Terbium, Tb)、鉺(Erbium, Er)~~雖然是有點沒創意。
順帶離題,加多林石裡另外四種新元素是
鈧(Scandium, Sc)←以斯堪地那維亞半島命名、
鈥(Holmium, Ho)←以斯德哥爾摩為名、
鈧(Scandium, Sc)←以斯堪地那維亞半島命名、
鈥(Holmium, Ho)←以斯德哥爾摩為名、
銩(Thulium, Tm)←意思是「遠的要命的地方」,希臘神話中指北歐
釓(Gadolinium, Gd):加多林(Johan Gadolin, 1760–1852)是位化學家,他的名字先被用來命名礦物加多林石,後來發現的元素又(在他過世之後)以他為名。加多林是名字登上週期表的第一個科學家,但是是週期表上第二個人名,第一個是釤(Samarium, Sm)。
↑*終極冷知識盡在這一段*↑
↑*終極冷知識盡在這一段*↑
釔鋇銅氧陶瓷是非常少見的高溫超導體,這邊「高溫」的定義是「可以泡在液態氮(-196°C )中就產生超導性質」的,顯然並沒有真的多溫暖。
因為它屬於第二類超導體,在「臨界溫度」以下不只電阻會變成貨真價實的零,還會有兩類「邁斯納效應」:會排斥磁場,同時結構上有一些漏洞的地方會讓磁場通過,但是卻像鉗子一樣把這些通過的磁場「鎖住」,隔磁又鎖磁,使得這裡所展示的兩種磁懸浮(騰空、倒吊可載重)成為可能。
但傷心的是,釔鋇銅氧雖然是歷史性的創紀錄的材料,但這種陶瓷的性質有兩個致命的問題:一是脆(陶瓷咩)、二是不能容納很大的電流,所以從發現到今天 30 多年了,可惜是仍沒有大規模的工業、商業用途。
所以釔鋇銅氧到今天的主要用途就是拿來展示科學實驗= =
不要灰心,和釔鋇銅氧類似的「稀土鋇銅氧」(REBCO)高溫超導材料近年來有突破性的進展——業者革新了製程,作出了長條狀的多層複合材料,叫「稀土鋇銅氧陶磁條」(REBCO tape)的材質。用途是用超導效應來產生強磁場。
強磁場在 MRI 造影、無線通信、各種發電機、高能物理、甚至用到電漿的磁禁錮核融合發電有各種用處。磁場密度提高一下就提升了許多既有科技的效率。
 |
| YBCO 的爭氣後代 REBCO tape 示意圖 |
演講到此結束了。而搜尋本篇文章的時間碼前面的黑方塊字元,可以知道 Chris Bishop 教授一邊講解一邊在這一個小時之內展示了 33 個實驗。請同意我,這是不可多得的超強化學展示,更沒有為了娛樂而虧待、犧牲到主題的深度。主教哥,我們謝謝您!




沒有留言:
張貼留言